Óxidos Básicos insolubles obtenidos Fe(OH)2, AlOH y Cu(OH)2

Fuente: Foto propia
Reacciones colores, calor y más colores químicamente las reacciones pueden producir diversas sustancias que nos fascinan por sus llamativas actividades moleculares, que terminan en un expulsión de calor por sus fuerzas intermoleculares o bien sea por un simple metal que solitario no tiene magnificencia pero al combinarse puede resultar en un hermoso resultado. En 3, 2, 1 aplicando la Ciencia con @Eleonardo
**SO4-2(ac) + Cu+2(s) ------> CuSO4(s) color Azul.**
Solubilidad:
La solubilidad es la capacidad de una solución de disolverse en un solvente, es decir; la máxima cantidad de un soluto en disolverse o diluirse en un solvente, a condiciones de presión y temperatura. Una solución que alcanzando el máximo de soluto disuelto se dice que está saturada, sin embargo si la solución admite más soluto de su capacidad se denomina solución sobresaturada. No todas las sustancias se disuelven en un mismo solvente ya que esta depende de la polaridad del compuesto y el solvente, el cual si ambas son polares o no polares son miscibles, en cambio sí una es una solución no polar como el aceite y el agua que es polar no se disolverán entre ellas. Otro factor importante que interfiere en la solubilidad es la presión, la temperatura y la constante del producto de solubilidad de los compuestos. ***Solubilización del Fe+2, Cu+2 y Al+ en la solución de ácido Sulfurico H2SO4, para formar Sulfato de CuSO4, FeSO4 y Al2SO4.***  *Fuente: Foto propia*Leyes de la solubilidad:
***Solubilidad en agua de algunos compuestos iónicos. (Solubles ≥ 0.1 M; Insolubles ≤ 0.01M)*** 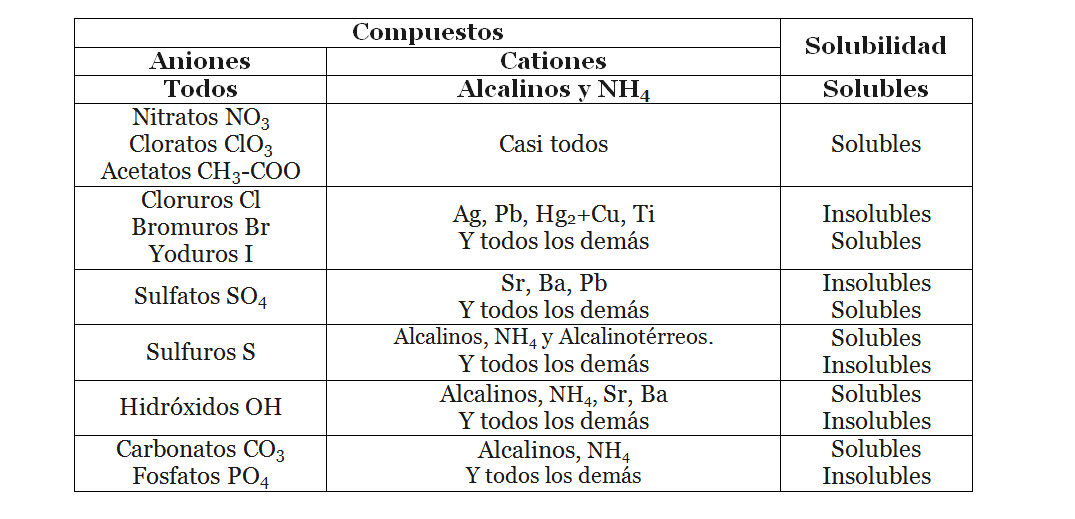 *Fuente: Tabla propia elaborada en Microsoft Word* Las reglas de solubilidad aplican para todos los compuestos cuando queremos hacer una reacción molecular o Redox, dejando claro si el producto que obtendremos será soluble en el agua o no, así como también es útil para separar compuesto de manera física haciéndolas reaccionar para que precipiten y aislar dicho compuesto por medio de una filtración como por ejemplo.Proceso de obtención de los precipitados de los Óxidos Básicos de Fe+2, Cu+2 y Al+
Para el proceso de obtención de los precipitados de los diferentes óxidos deseados por medio de las leyes de la solubilidad, debemos primero que nada preparar las soluciones solubles de las sales producidas con el ácido sulfúrico: **Preparación de las sales de Cobre, hierro y Aluminio con ácido Sulfúrico:** Para la preparación de las sales tenemos en esta oportunidad un ácido sulfúrico concentrado comercial para baterías, el cual se tomaran 3 vasos precipitados y se agregara el ácido en ellos. Posteriormente se le agregara unos mililitros de agua oxigenada el cual usaremos como catalizador para acelerar las reacciones al momento de introducir los metales en cada vaso precipitado (Cobre, hierro y aluminio), para formar las sales. Una vez los metales estén la solución estos reaccionaran para formar:
**SO4-2(ac) + Cu+2(s) ------> CuSO4(s) color Azul.**
**SO4-2(ac) + Fe+2(s) ------> FeSO4(s) color Verde.**
**SO4-2(ac) + 2Al+1(s) ------> Al2SO4(s) sin color aparente.**
Así mismo sería una reacción lenta sino se agrega el agua oxigenada al 30%, sin embargo ya que la más común en el Mercado es la de 10%, también se puede usar pero será un poco lenta, llevándose acabo en 1 día y medio en consumirse todos los metales presentes en cada una de las soluciones.
En el caso del sulfato de aluminio también se preparó disolviendo Alumbre en agua ya que el mismo es sulfato de aluminio.
***Solución de ácido sulfúrico reaccionando con el aluminio solido Al+1.***

*Fuente: Foto propia*
**Precipitación de los hidróxidos de Cobre, hierro y Aluminio con Hidróxido de Sodio concentrado:**
Para hacer precipitar los metales presente en las soluciones debemos usar un agente precipitante mediante las leyes de la solubilidad, para adecuar las reacciones capaces de precipitar, y es por ello que se escogió el hidróxido de Sodio ya que todos hidróxidos precipitan excepción de aquellos combinados con metales alcalinos.
CuSO4(ac) + NaOH(ac) ------> Cu(OH)(2)(s)
FeSO4(ac) + NaOH(ac) ------> Fe(OH)(2)(s)
**Al2SO4(ac) + NaOH(ac) ------> AlOH(s)**
Posteriormente de agregar el hidróxido de sodio, este precipitara inmediatamente formando un suspendido coloidal blanco para el aluminio, verde para el hierro y azul para el cobre, el cual se presentara a continuación la demostración práctica de la precipitación de Óxidos Básicos.
Video de todo el procesos de preparación de las soluciones hasta el precipitado https://youtu.be/MLwWUd9XPiE
Fuente: Video propio
Como pudieron observar es muy sencillo preparar nuestras propias soluciones en casa aplicando los conocimientos básico necesarios para producir una reacción dada, y en el caso de que tengamos una solución contaminada con un metal pesado, podemos separarlos aplicando las leyes de la solubilidad para hacerlos precipitar y por ende usando técnicas como el filtrado los podemos eliminar y así limpiar las soluciones que tenemos.
Por otra parte al tener estas soluciones separadas podemos obtener nuestros propios reactivos para futuros experimentos que deseemos realizar, en este caso filtramos y secamos los hidróxidos obtenidos y los almacenamos respectivamente según su norma de seguridad.
***Óxidos Básicos insolubles obtenidos (Fe(OH)2, AlOH y Cu(OH)2)***

*Fuente: Foto propia*