Principio de Le Chatelier

Fuente: Imagen Compuesta/kropekk_pl-21 Mayo 2017 , jpornelasadv-18 Septiembre 2014/ Pixabay.com
¿Creían que solo la física es fascinante? Pues químicamente les mostrare el interesante mundo en el que vivió nuestro ingenioso colega Henry Le Chatelier en el sub mundo molecular del equilibrio químico. En 3, 2, 1 aplicando la Ciencia con @Eleonardo
#
***Henry Louis Le Châtelier, fue un químico Francés.***
Principio de Le Chatelier:
El Principio del químico Le Chatelier, se refiere a que cuando un estado de equilibrio químico se mantiene no variara mientras las condiciones del sistema no se modifique. Cuando cambia un parámetro, como por ejemplo los tres casos existentes, la temperatura, la presión y la concentración de algunos de los reactivos o de los productos en equilibrio, la reacción tendera a cambiar bien sea a consumirse los reactivos para producir más producto o el producto se descompondrá para generar más reactivo hasta alcanzar un nuevo estado de equilibrio. *Entendamos que A + B producen C* Donde A + B son los Reactivos y C el producto Una vez entendida la conceptualización del principio expliquémoslo con más detalles y con varios ejemplos puntuales. ***Ejemplo de las bebidas gaseosas: 2CO2 + H2O produce H2CO3 +CO2*** Tanto los reactivos como los productos están en equilibrio; es decir; para producir una bebida gaseosa necesitaríamos 2 moléculas de CO2 (Dióxido de Carbono) y 1 molécula de H2O (Agua) para producir 1 molécula de H2CO3 (ácido Carbónico) y 1 molécula de CO2 gaseoso libre. ***Ecuación química de las bebidas gaseosas.*** 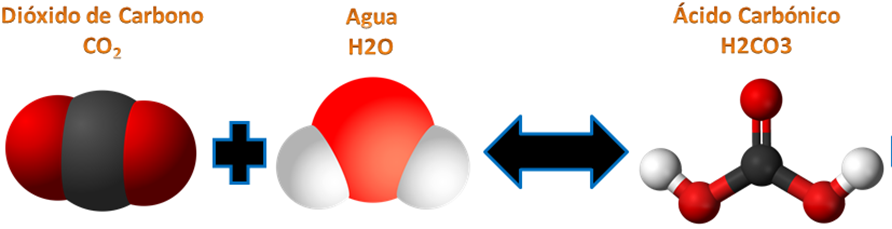 *[Fuente: Jacek FH, 7 October 2007/ Wikipedia.com/CC BY-SA/ ]( https://pixabay.com/es/photos/?q=molecula+de+co2&hp=&image_type=all&order=popular&cat=&min_width=&min_height=)*Caso N° 1: Equilibrio química por temperatura.
Para entender este caso debemos entender primero que significa la entalpia para conocer si nuestra reacción es Exotérmica (Libera energía) o endotérmica (Absorbe energía); que no es más que una magnitud que expresa la variación o diferencial de energía absorbida o liberada por un sistema termodinámico. • *Si es endotérmica,* al aumentar el equilibrio químico se desplaza hacia la derecha para formar productos. En cambio, si la temperatura baja el equilibrio químico de la reacción se desplaza hacia la izquierda generando reactivos. • *Si es exotérmica,* al aumentar la temperatura equilibrio químico de la reacción se desplaza hacia la izquierda generando reactivos por la descomposición de los productos, mientras que si la temperatura disminuye, el equilibrio se desplaza hacia la derecha consumiendo los reactivos en productos. ***Equilibrio químico por temperatura de las bebidas gaseosas.*** 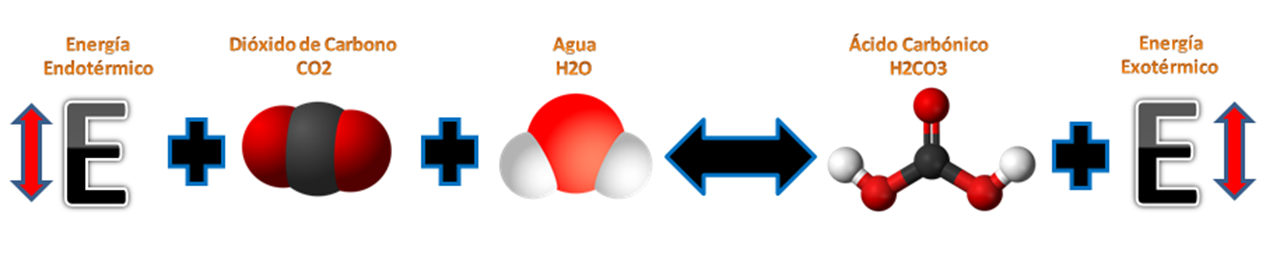 *[Fuente: Jacek FH, 7 October 2007/ Wikipedia.com]( https://pixabay.com/es/photos/?q=molecula+de+co2&hp=&image_type=all&order=popular&cat=&min_width=&min_height=)*Caso N° 2: Equilibrio químico por Presión.
En cuanto la presión, esta se refiere a que si se aumenta la presión esta tiende a formar más productos consumiendo los reactivos y si baja la presión, los productos se consumen para formar nuevamente los reactivos. ***Equilibrio químico por presión de las bebidas gaseosas.*** 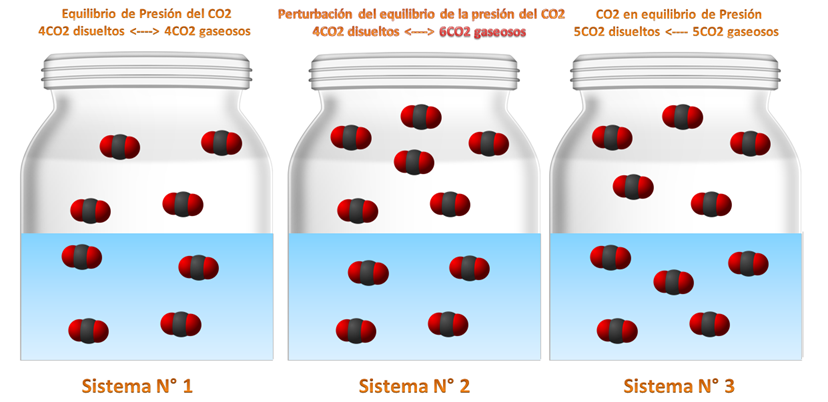 *[Fuente: OpenClipart-Vectors, 13 de Julio de 2013 /Pixabay.com]( https://pixabay.com/es/tarro-vidrio-frasco-vac%C3%ADo-162166/)* **Sistema N° 1:** como verán tenemos que en el sistema 1, hay 4 moléculas de CO2 disueltos y 4 moléculas de CO2 gaseosas libres lo que están equilibrio. **Sistema N° 2:** por otra parte si perturbamos el sistema como se aprecia agregándole 2 moléculas de CO2 este se desequilibra porque la relación queda 6 gaseosas y 4 disueltas. **Sistema N° 3:** ahora la reacción buscara equilibrarse haciendo que la reacción busque a la derecha ósea a los productos disolviendo 1 molécula de CO2 en el agua equilibrándose así una vez más.Caso N° 3: Equilibrio químico por Concentración.
***Equilibrio químico por concentración de las bebidas gaseosas.*** 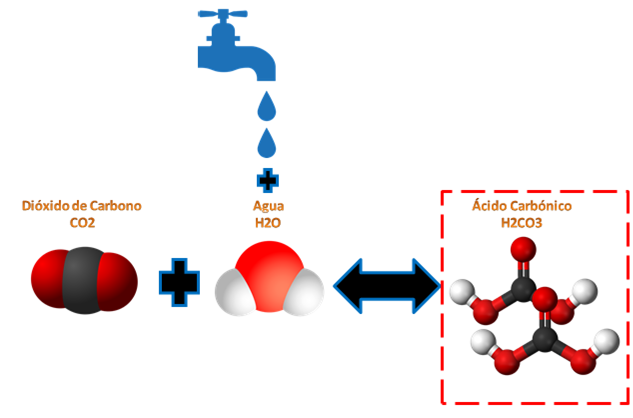 *[Fuente: Stampf, 30 de Noviembre de 2015/Pixabay.com]( https://pixabay.com/es/grifo-el-agua-silueta-azul-goteo-1066626/)* Para el caso de los equilibrios químicos por concentración, tenemos que si una reacción de 2CO2 + H2O produce H2CO3 +CO2 tal como vemos en la imagen, si se perturba agregándole más reactivo en este caso más agua, este buscara el equilibrio reaccionando el CO2 para producir más H2CO3 y así volver al equilibrio de la reacción. Bueno ya explicado todo el principio de Le Chatelier, vallamos a la demostración visual. Aquí vamos!! ***Demostracion del Equilibrio químico adaptada a las bebidas gaseosas.***https://youtu.be/W559M_U-aus
Fuente: Sergio Paredes, 15 de Julio de 2014/cluster-divulgacioncientifica.blogspot.com
Fuente: Permiso de uso de Sergio Paredes, 1 de Abril de 2018/imgbb.com
Primero que nada tenemos una botella de agua con conchas de mar (CaCO3) el cual se le agrega agua (H2O) y ácido clorhídrico concentrado el cual produce cloruro de calcio (CaCl2), y dióxido de Carbono (CO2) representando así la siguiente reacción:
CaCO3 + H2O + 2HCl = CaCl2 + 2H2O + CO2 si tomamos de la ecuación lo siguiente, nos queda:
2CO2 + H2O produce H2CO3 +CO2 (en equilibrio)
Una vez en equilibrio, vemos en la demostración como el CO2 está disuelto en el agua y el que está libre en la botella a una concentración, temperatura y presión constante una vez llega al equilibrio. Pero si perturbamos la reacción cambiando su presión al abrir la botella, se puede apreciar cómo se libera el CO2 disuelto en el agua, tratando de equilibrar la reacción generando más CO2 gaseoso.
Pero una vez se le agrega más CO2 a la botella vemos como las burbujas de CO2 desaparecen y deja de liberar el gas, lo que quiere decir que la reacción se inclinó hacia los productos disolviendo el CO2 en el agua creando mas H2CO3.
Bueno mis estimados colegas espero que el mundo molecular de la química de las reacciones les haya dado otra perspectiva de lo que ocurre cuando abrimos una gaseosa y no las tomamos, la curiosidad por lo que no vemos es lo que nos lleva apreciar más las cosas y entender al mundo que nos rodea.
Gracias y hasta la próxima.