Solución Básica de Hidróxido de Sodio (NaOH)

Fuente: Foto propia
Soluciones, concentraciones, colores, el mundo de las reacciones químicas y sus derivados visuales mostrándonos que todo es posible cuando combinamos los reactivos indicados, si conocemos como están compuestos y en qué cantidad las tenemos. Incluso peligro si no sabemos qué tan concentrado esta un líquido indefenso a simple vista, pero descubre como una sustancia puede indicarte cuando está en el punto de óptimo para conocer su concentración. En 3, 2, 1 aplicando la Ciencia con @Eleonardo
Neutralización o Estandarización Ácido Base.
Una Estandarización ácido-base, también llamada titulación ácido-base, volumetría ácido-base, equivalente de neutralización y valoración, es una técnica de análisis cuantitativo usada, que mediante ella podemos conocer la concentración de una sustancia que pueda ser un ácido que será neutralizada por una base de concentración conocida, o bien sea por medio de una concentración de base desconocida que será neutralizada por un ácido conocido. Este tipo de valoración se basa en una reacción de neutralización entre el analito, que no es más que la sustancia cuya concentración deseamos conocer y la sustancia valorante. Es decir; que podemos determinar la concentración de una sustancia por medio de otra conocida, cuando alcanzamos la neutralización de la solución, ósea, cuando los moles del ácido se igualan a los moles de la base o que es lo mismo cuando todos los moles del ácido reaccionan con todos los moles de la base para formar una sal, y es allí cuando se conoce como el punto de equivalencia de la sustancia. ***Neutralización o Estandarización Ácido Base con Fenolftaleína***  *Fuente: Foto propia*Proceso de Neutralización o Estandarización del NaOH con H2SO4.
Para la titulación del Hidróxido de Sodio (NaOH), que es una base fuerte, se debe utilizar un ácido fuerte en este caso el Ácido Sulfúrico (H2SO4), que neutralice la base de NaOH. Para ello necesitaremos observar el punto de neutralización o de equivalencia por medio de un indicador que en cuanto a sus cambios de color debido a los intervalos de pH de la solución nos muestre el preciso momento en que la solución allá reaccionado por completo los moles del ácido con la base, dándonos así el color característico de la estandarización. ***Proceso de titulación o neutralización del NaOH con H2SO4***  *Fuente: Foto propia* Para ello es necesario utilizar una bureta que nos permita agregar gota a gota de la solución valorante, para que así sea más exacta y se pueda observar el punto de equivalencia. Así como la preparación de ambas soluciones tanto del ácido como de la base, si la misma está muy concentrada se deben diluir lo necesario para no gastar tanto reactivo titulante. En este caso la solución de hidróxido de sodio se diluyo 1.5 mililitros en 3 litros de agua, que posteriormente se agregaron 10 mL de esta solución en el Erlenmeyer donde se titularía y la solución de H2SO4 estaba previamente estandarizada a 0.05 Molar (Mol/Litro), que es la solución de referencia. ***Esquema de preparación de las soluciones y titulación*** 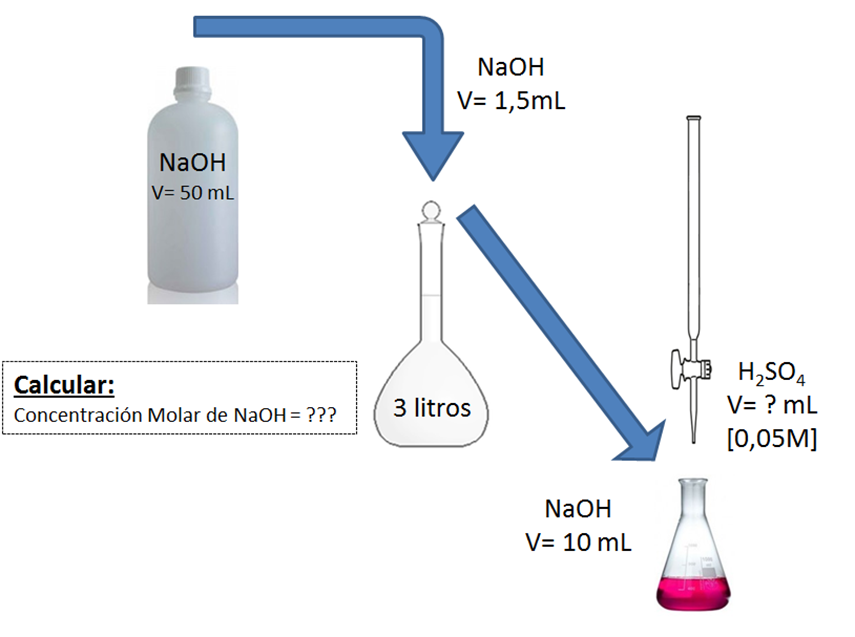 *[Fuente: Diseñado y editado por mi: Xavax, 10 de marzo de 2010/wikimedia.org](https://commons.wikimedia.org/wiki/File:1000_ml_Erlenmeyer_flask.svg)* Para esta demostración implementaremos como indicador de preferencia por ser acido base, la Fenolftaleína, que en medio ácido no reacciona o que es lo mismo no presenta color, por otro lado este indicador cuando se encuentra en medio básico posee un color fucsia característico. En cambio cuando la solución se encuentra en un punto neutro, es decir que se llegó al punto de equivalencia, se debe buscar el momento en que la solución cambia de fucsia a transparente. ***Colores indicadores de la Fenolftaleína según el pH***  *Fuente: Imagen propia* Sabiendo todo lo referente al indicador, y los fundamentos de la estandarización procedemos a visualizar la demostración práctica del método.Video del proceso de estandarización del NaOH con H2SO4 https://youtu.be/9zThCZTkheI
Fuente: Video propio
Una vez titulado la solución pudieron observar cómo se iba agregando el ácido sulfúrico al hidróxido de sodio y no ocurría nada, pero tras 4 pipetas de 10 mL empezó a tornarse el color fucsia un poco más tenue cada vez, hasta que casi se puso transparente, indicando que se habíamos alcanzando el punto final de la titulación y la reacción había reaccionado por completo (2NaOH + H2SO4 -> Na2SO4 + 2H2O). Obteniendo así que el volumen gastado fue de 43.4 mL de H2SO4. Así que se les mostrara los cálculos realizados para la determinación de la concentración de NaOH que tengo en casa.
***Calculo de la concentración inicial del NaOH***
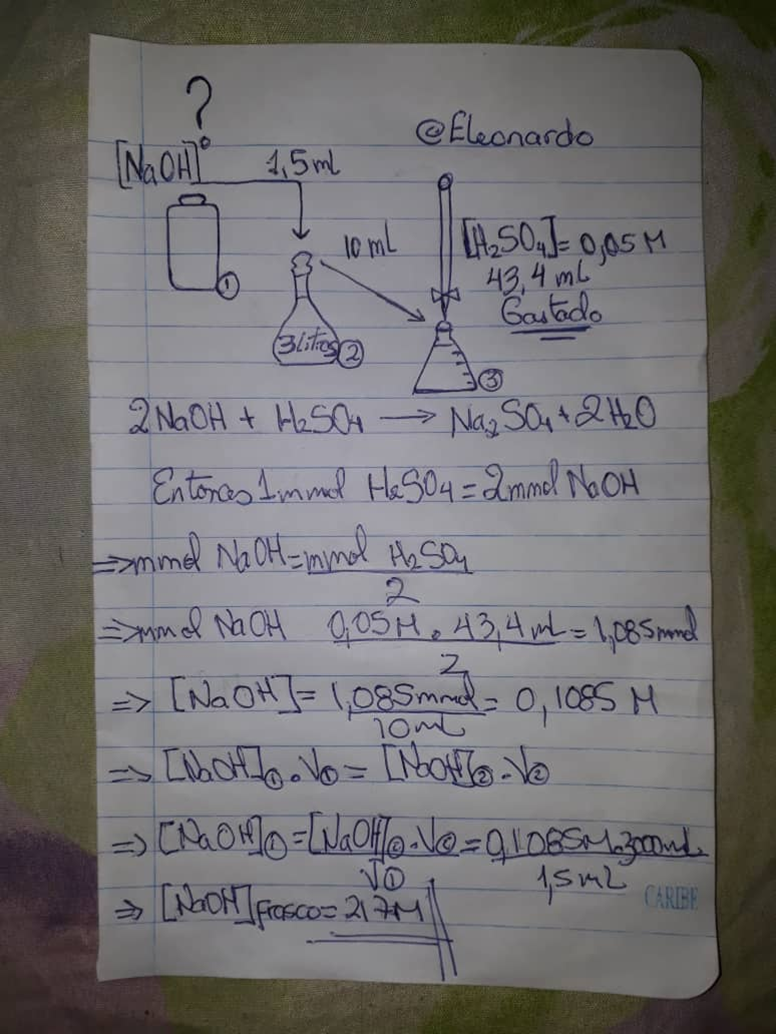
*Fuente: Foto propia*
Para nuestra concentración inicial de NaOH encontrada es de 217 molar, lo que es justificada, ya que se tenía en escamas pero debido a una mala manipulación el NaOH absorbió humedad y se volvió una solución muy concentrada tanto así que se tuvo que disolver un poco más ya que la misma estaba sobre saturada debido a la evaporación del agua y estaba precipitando en cristales. También podemos usar esta solución para determinar la concentración por ejemplo del Ácido sulfúrico que se usa para las baterías de carro el cual el fabricante no proporciona dicha información.
***Hidróxido de Sodio concentrado***

*Fuente: Foto propia*
A veces tenemos líquidos o soluciones que las agregamos a otra para preparar algo y simplemente lo hacemos al ojo porciento creyendo que todo resultara bien y cuando lo probamos vemos como esa solución nos reseca la piel o nos irrita, bien sea porque nos pasamos de ácido o de base, afectando el pH de nuestro producto final. Por eso es importante siempre tener estas nociones básicas para controlar las concentraciones finales de lo que deseamos, la química es exacta y perfecta, los colores son hermosos y las moléculas son misteriosas como trabajan en el submundo microscópico de la química de las reacciones.
Hasta pronto
Referencias: