Seda Sintética obtenida mediante la Polimerización

Fuente: Foto propia @eleonardo
Hola colegas científicos y lectores apasionados a la ciencia de @stem-espanol y @steemstem. A veces los procesos químicos industriales los vemos como una masa de mucha información complicada y difícil de entender, pero en esta oportunidad les presentare un proceso industrial que en su momento fue usado para sintetizar la Seda, pero que hoy en día no es usado en muchos países ya que existen procesos naturales más eficientes y ecológicos, pero que a su vez no podemos olvidar la base de lo que fue en su momento la obtención de un material de gran importancia en nuestros días. Es por ello que les demostrare como se sintetizaba la Seda de manera experimental y simple. En 3, 2, 1 aplicando la Ciencia con @Eleonardo
Que es la Seda Sintética o Seda cuproamoniacal:
La Seda es una clase de fibra de la celulosa del algodón que es solubilizada y que posteriormente se regenera mediante un reactivo para formar la tela. El Alemana Bemberg J. P, en 1919 logra producir la Seda Sintética a partir de la Polimerización de la celulosa con Hidróxido de amonio y Carbonato de cobre, es por ello que esta fibra es más delgada o fina que la seda producida naturalmente y a su vez más costosa. Para este proceso la celulosa es tratada con el reactivo de Schweitzer que es preparada por la reacción química de la solución de hidróxido de amonio con Carbonato de cobre. *** Cu2(OH)2CO3(s) + 8NH4OH --> 2(Cu2(NH3)4(H2O))CO3(ac) *** La disolución del Carbonato de cobre en amoniaco obtenida me la reacción, tiene el nombre de reactivo de Schweitzer, el cual es altamente básico y reacciona con los hidroxilo libre que se encuentran en las cadenas de la celulosa, formando así un complejo de cobre, que es soluble en agua. La solución viscosa obtenida se agrega en una solución de ácido sulfúrico diluido para regenerar o polimerizar la celulosa en Seda Cuproamonio. Es por ello que estas Sedas obtenida son de mayor calidad que las naturales. ***Estructura química de la celulosa y la Seda*** 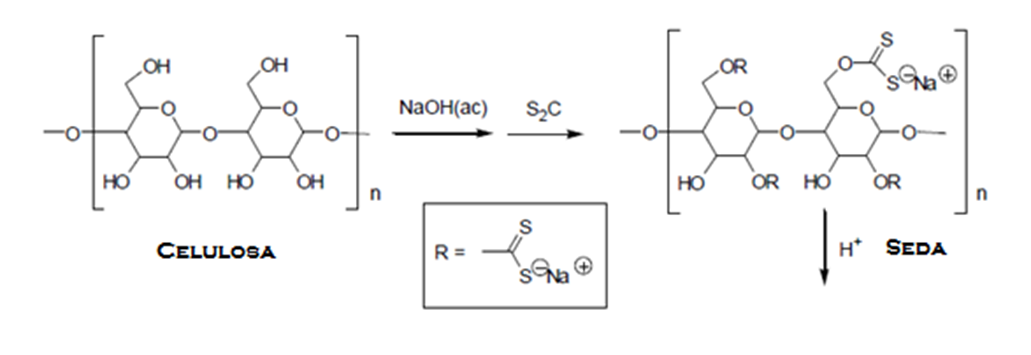 *Fuente: Imagen propia creada en el Editor Paint*Materiales y Reactivos.
***Materiales*** Pipeta Probeta Papel filtro Espátula Matraz aforado Vasos de precipitado Vidrio reloj Jeringa con aguja ***Reactivo*** Sulfato de cobre Amoniaco Ácido sulfúrico AlgodónProcedimiento del proceso
* En un vaso precipitado con agua en punto de ebullición (Para aumentar la solubilidad) se agrega 250 g de sulfato de cobre y 150 g de bicarbonato de sodio en sus respectivos vasos precipitados para disolverlos. ***Sulfato de cobre y bicarbonato de sodio en solución***  *Fuente: Foto propia* Nota: En mi caso no contaba con el sulfato cobre en polvo listo para usar, lo que tuve que crearlo a partir de la reacción de ácido sulfúrico con una lámina de cobre por varios días hasta obtener una solución concentrada. * Se mezclan ambas soluciones con lentitud para evitar que se derrame la solución por la acción de las burbujas de dióxido de carbono que se forman en la reacción y una vez culminada toda la reacción, obtendremos el precipitado de Carbonato de cobre que necesitamos. **La reacción resultante: CuSO4 + NaHCO3 --> Cu2(OH)2CO3 +Na2SO4 + H2O + CO2 ** ***Interfaz del Carbonato de cobre y el sulfato de cobre reaccionando***  *Fuente: Foto propia* * Para separar el carbonato de cobre, haremos uso de un embudo con su papel filtro y con mucha paciencia lo filtraremos y dejaremos secar. ***Carbonato de cobre obtenido después de la filtración***  *Fuente: Foto propia* * Pesaremos 5 g del carbonato de cobre y le agregaremos 30 mL de hidróxido de amonio al 25% en volumen para formar el reactivo de Schweitzer, el cual es un complejo de formación. ***La reacción resultante: Cu2(OH)2CO3(s) + 8NH4OH --> 2(Cu2(NH3)4(H2O))CO3(ac) *** * Agregaremos 1 g de algodón a la solución del complejo de cobre y lo agitamos bien. ***Solución de la viscosa***  *Fuente: Foto propia* * Por ultimo preparemos una solución de ácido sulfúrico entre 1 a 2 molar de concentración y con una jeringa vamos agregando las solución de viscosa al ácido para que se formen los hilos de Seda sintética. Nota: los hilos saldrán azules pero la solución ácida absorberá el cobre volviendo los hilos de color blancos los cuales lavaremos posteriormente con agua.Video del proceso de la Seda Sintética obtenida mediante la Polimerización https://youtu.be/y1eykV2LCBg
Fuente: Video propio
Como pudieron observar en el proceso de la Seda sintética, se formaron los hilos de mediante se iba agregando con la jeringa la solución de la viscosa del ion complejo de cobre. Esto a nivel industrial usa máquinas que con un dispensador con muchas ranuras libera la viscosa y un rodillo va enrollando el hilo el cual cuando está totalmente enrollado en una bobina se lava o se cura con agua para retirar el ácido del mismo. Así como también dependiendo de uso que se le vaya a dar se tiñe de color para obtener las telas que comúnmente usamos en el día día.