Electrolisis del Agua

Fuente: Nevit Dilmen, Julio de 2010/ wikipedia.org/CC BY-SA
Sin duda alguna la química tiene áreas muy interesantes que nos pueden mostrar reacciones muy violentas, a veces muy lentas, sin mucha extravagancia, también tenemos unas muy vistosas con colores espectaculares, que sin embargo no vemos físicamente que está ocurriendo entre los átomos o las moléculas, pero de algo si estoy seguro, algo ocurre y pues en una reacción Redox (oxido-reducción) podemos observar que ocurre, como las molecular interactúan en reacciones que se a precian a simple vista, por eso les demostrare el increíble mundo molecular de una reacción de oxidación y reducción. En 3, 2, 1 aplicando la Ciencia con @Eleonardo
Electrolisis del Agua:
La definición de la electrolisis del agua es muy simple, pues consiste en un proceso electroquímico, es decir de oxidación y de reducción de uno más elementos que por medio de la inducción de corriente eléctrica se descompone la molécula del agua (H2O), produciendo así hidrógeno y oxígeno gaseoso. Teniendo así la reacción que deseamos obtener: **2H2O + Energía |produce| 2H2 + O2** ***Reacción química del Agua*** 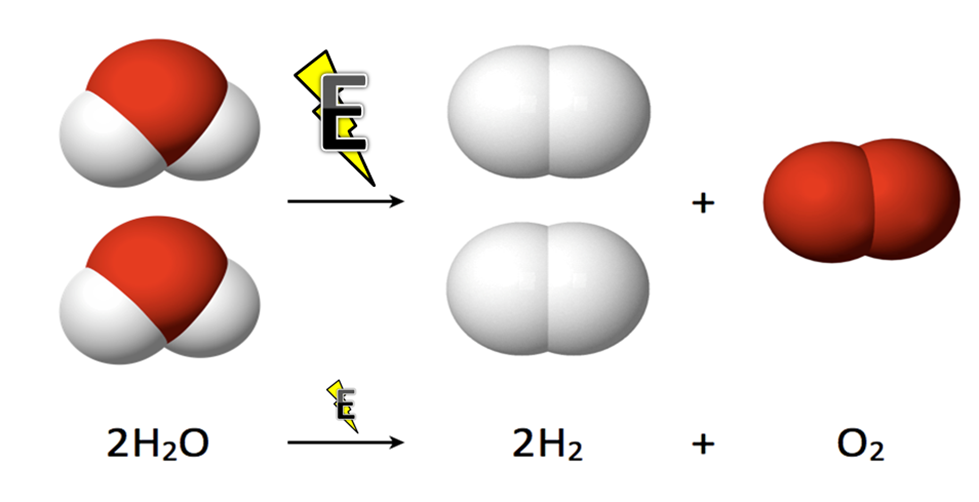 *[Fuente: JSquish, 16 de noviembre de 2013/ wikipedia.org/CC BY-SA ](https://en.wikipedia.org/wiki/Electrolysis_of_water#/media/File:Electrolysis_of_Water.png )* El procedimiento y los materiales a usar son sencillos y fáciles de conseguir. Una fuente de alimentación eléctrica que se conecta a dos electrodos, que por lo general deben estar hechas de un metal inerte como el acero inoxidable o el platino para evitar que reaccionen, en el cual deben estar colocados en el agua. Por otra parte también pueden ser electrodos que tengan afinidad o específicos con lo que se desea hacer. En la celda de hidrógeno el cátodo es el electrodo con carga negativa, y el oxígeno aparecerá en el ánodo con carga positiva. Por otra parte el agua por sí sola no es muy buena conductora de electricidad y más si es pura, ósea; el agua destilada no es conductora lo que nos llevaría a utilizar un medio electrolítico, que no es más que una solución con altos contenidos de iones para transportar o permitir el paso de la corriente eléctrica al agua, para que así esta se descomponga, o se separe en hidrógeno y oxígeno respectivamente. ***Celda electroquímica química del Agua***  *[Fuente: Mbarousse , 16 de mayo de 2004/ wikipedia.org ](https://upload.wikimedia.org/wikipedia/commons/f/f6/Electr%C3%B3lisis.png )* Sin embargo por ser un sistema abierto se nos dificulta atrapar los gases liberados, lo cual estaré implementando un sistema casero para atraparlos y medir su volumen y así comprobar que la teoría complementa la práctica cuando nos referimos a la reacción el cual, la relación esta 2:1, que por cada dos moléculas de hidrógeno liberado sale un molécula de oxígeno. Los que nos tiene que quedar con el doble de volumen que el oxígeno.Materiales y reactivos a utilizar:
• **Cuba de vidrio. • Tornillos de acero inoxidable. • Cables de corriente. • Cargador de celular. • Inyectadoras. • Agua. • Sosa caustica.** Como ya les había mencionado por el cátodo se recogerá el hidrógeno y por ánodo el oxígeno, es importante mencionar que usar otra solución electrolítica que no sea el NaOH Sosa caustica (Hidróxido de Sodio), como por ejemplo otro electrolito que tenemos en casa como lo es el NaCl sal común (Cloruro de Sodio), presenta un inconveniente como lo es la reacción del Cloro ya que también liberaría el Cloro gaseoso siendo este toxico, y una impureza para los productos que deseamos obtener.Proceso de la Electrolisis del agua y la obtención del Hidrógeno y Oxígeno gaseoso : https://youtu.be/Z7nnFFH4nvw
• Impresionante verdad? es evidente como se ven las moléculas de estos dos gases que son separadas y recolectadas en recipientes volumétricos diferentes, se puede apreciar como el hidrógeno se extrae por el cátodo que el polo positivo y en el ánodo positivo se extrae el oxígeno.
• Uno de los objetivos principales era obtener los gases por medio de la electrolisis, y demostrar que la reacción química planteada **2H2O + Energía |produce| O2 + 2H2** se diera en la experiencia práctica es decir; que de verdad salieran por cada dos moléculas de hidrogeno se obtuviera una de oxígeno. Y de hecho al final la práctica se recolecto 20 mililitros de hidrogeno y 10 mililitros de oxígeno, lo cual cumple con la teoría de estar a la proporción 2:1. Que por medio de la ecuación de gases ideales P.V= nRT (P= presión, V= volumen, R= constante de los gases, T= temperatura y n= los moles que deseemos calcular), se calcula los moles obtenidos.
***Hidrógeno y Oxígeno gaseoso obtenido:***

*Fuente: Elaboración propia*
• Obtenemos la reacción química real en base a los moles obtenidos:
**0.001215H2O + Energía |produce| 0.000405O2 + 0.00081H2**
Que por cada 0.001215 moles de agua que se procesó racionaron para formar 0.00081 moles de Hidrógeno y 0.000405 moles de oxígeno. En lo que equivale en peso a:
**0.81 mg de Hidrógeno gaseoso.
6.48 mg de Oxigeno gaseoso.**
• Por ser el oxígeno más pesado que el hidrógeno se obtuvo más masa aunque molecularmente es la mitad de hidrógeno obtenido.
Es hermosa la química que nos rodea, y ver desde otro punto de vista que el agua que tomamos puede ser separada con tal facilidad, que nos enseña que la vida es sostenida por dos elementos increíbles de la ciencia.
Hasta la próxima
***Selfie con el experimento***

*Fuente: Elaboración propia*