Allí, él establece que la R es la Constante de Rydberg y tiene un valor de 1.097 x 10 a la menos 7 metros a la menos 1.
Ahora bien, una pregunta muy acertada que surge de todo eso es, ¿Existen otras series de líneas que corresponden a otros valores fijos? Pues la verdad es que seguidamente aparecieron otros científicos que presentaron series diferentes para el infrarrojo y otra para la ultravioleta.
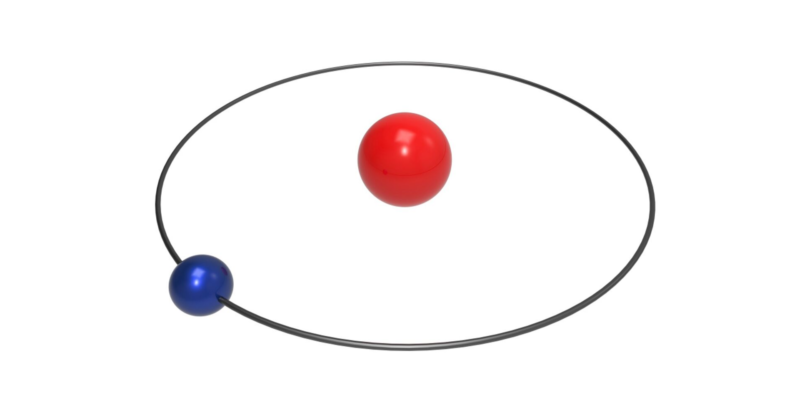
Pero la clave para poder comprender mejor esa fórmula la presentó Niels Bohr en 1913, inmediatamente se dio cuenta de la importancia del modelo atómico presentado por Rutherford para poder comprender esta estructura. Partiendo de allí, Bohr propuso un modelo en el que el electrón gira alrededor del núcleo, Pero también estableció que ese modelo violaría una de las predicciones de la física clásica, que dice que cuando un electrón es acelerado emitirá un espectro de radiación continuo al perder energía y dirigirse en espiral hacia el núcleo.
There, he establishes that R is the Rydberg constant and has a value of 1.097 x 10 to the minus 7 meters to the minus 1.
Now, a very pertinent question that arises from all this is, are there other series of lines that correspond to other fixed values? Well, the truth is that other scientists soon appeared who presented different series for infrared and another for ultraviolet.
But the key to better understanding this formula was presented by Niels Bohr in 1913, who immediately realized the importance of Rutherford's atomic model in understanding this structure. Starting from there, Bohr proposed a model in which the electron revolves around the nucleus. However, he also established that this model would violate one of the predictions of classical physics, which states that when an electron is accelerated, it will emit a continuous spectrum of radiation as it loses energy and spirals toward the nucleus.
[Source](https://concepto.de/hidrogeno/)
Pero cuando Bohr se da cuenta que la física clásica ya no podía dar respuesta a esto, entonces surge un inconveniente con el átomo de hidrógeno. Es allí cuando Bohr presentó tres postulados y estos se convirtieron en las características básicas que condujeron a una teoría moderna. Cabe resaltar que estos postulados no solo se aplican para el átomo de hidrógeno sino a sistemas atómicos, moléculas y nucleares de todas las clases. Estos postulados son los siguientes:
1- Los estados estacionarios: El supuso que el átomo de hidrógeno puede estar presente durante mucho tiempo sin irradiar en ninguno de los estados estacionarios de energía.
2- La frecuencia: El átomo de hidrógeno puede emitir o absorber radiación solamente cuando el átomo cambia de un estado estacionario a otro. No obstante, la energía emitida por el fogón es igual a la diferencia de energía entre estos dos estados, así el átomo de cambia de un estado de energía inicial a uno final, y la energía del fotón está dada por la siguiente expresión:
But when Bohr realized that classical physics could no longer provide an answer to this, a problem arose with the hydrogen atom. It was then that Bohr presented three postulates, which became the basic characteristics that led to a modern theory. It should be noted that these postulates apply not only to the hydrogen atom but to atomic, molecular, and nuclear systems of all kinds. These postulates are as follows:
1- Stationary states: He assumed that the hydrogen atom can be present for a long time without radiating in any of the stationary energy states.
2- Frequency: The hydrogen atom can emit or absorb radiation only when the atom changes from one stationary state to another. However, the energy emitted by the burner is equal to the energy difference between these two states, so the atom changes from an initial energy state to a final one, and the energy of the photon is given by the following expression:
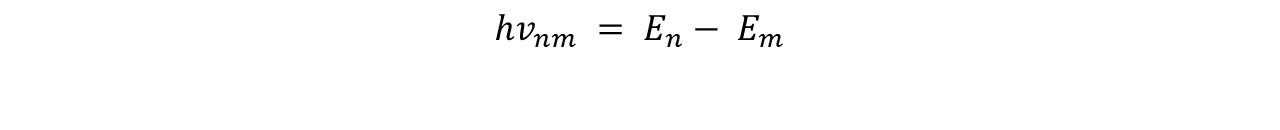
Y es dicho postulado el que enlaza dos grandes ideas, la primera de ellas es la hipótesis del fotón y la segunda es la cuantización de la energía, todo esto con otra vieja idea que es la conservación de la energía.
And it is this postulate that links two major ideas, the first being the photon hypothesis and the second being the quantization of energy, all of this with another old idea, which is the conservation of energy.
-----------
Ya para despedirme espero que el tema sea del agrado de los lectores y deseo ver en los comentarios sus opiniones y aportes significativos que ayuden a la ampliación del tema y que genere un debate crítico y enriquecedor para la satisfactoria divulgación del conocimiento científico
In closing, I hope that the topic is to the readers' liking and I hope to see in the comments your opinions and significant contributions that will help to broaden the topic and generate a critical and enriching debate for the satisfactory dissemination of scientific knowledge.
--------------
Referencias
Halliday, D; Resnick, R & Krane K. (1999). Física Volumen 2. Compañía Editorial Continental: México.
References
Halliday, D; Resnick, R & Krane K. (1999). Physics Volume 2. Continental Publishing Company: Mexico.
-----------------------
Traductor Deepl
Translator Deepl
---------------


#stem-espanol
#spanish
#ciencia
#educacion
#hidrogenatom
#bohrtheory
#cuantica
#fisica
#posh
#creativecoin
Payout: 0.000 HBD
Votes: 388
More interactions (upvote, reblog, reply) coming soon.